Ngày 25/6, Bộ Y tế, Hội đồng Đạo đức quốc gia tổ chức họp khẩn với các đơn vị liên quan đánh giá tiến độ thử nghiệm và kế hoạch mở rộng địa điểm thử nghiệm vắc-xin Nano Covax của Công ty Nanogen.
Về quá trình nghiên cứu, sản xuất vắc-xin Nano Covax, từ tháng 4/2020, Công ty Nanogen đã bắt tay tìm hiểu nghiên cứu thuốc và vắc-xin ngừa virus SARS-CoV-2.
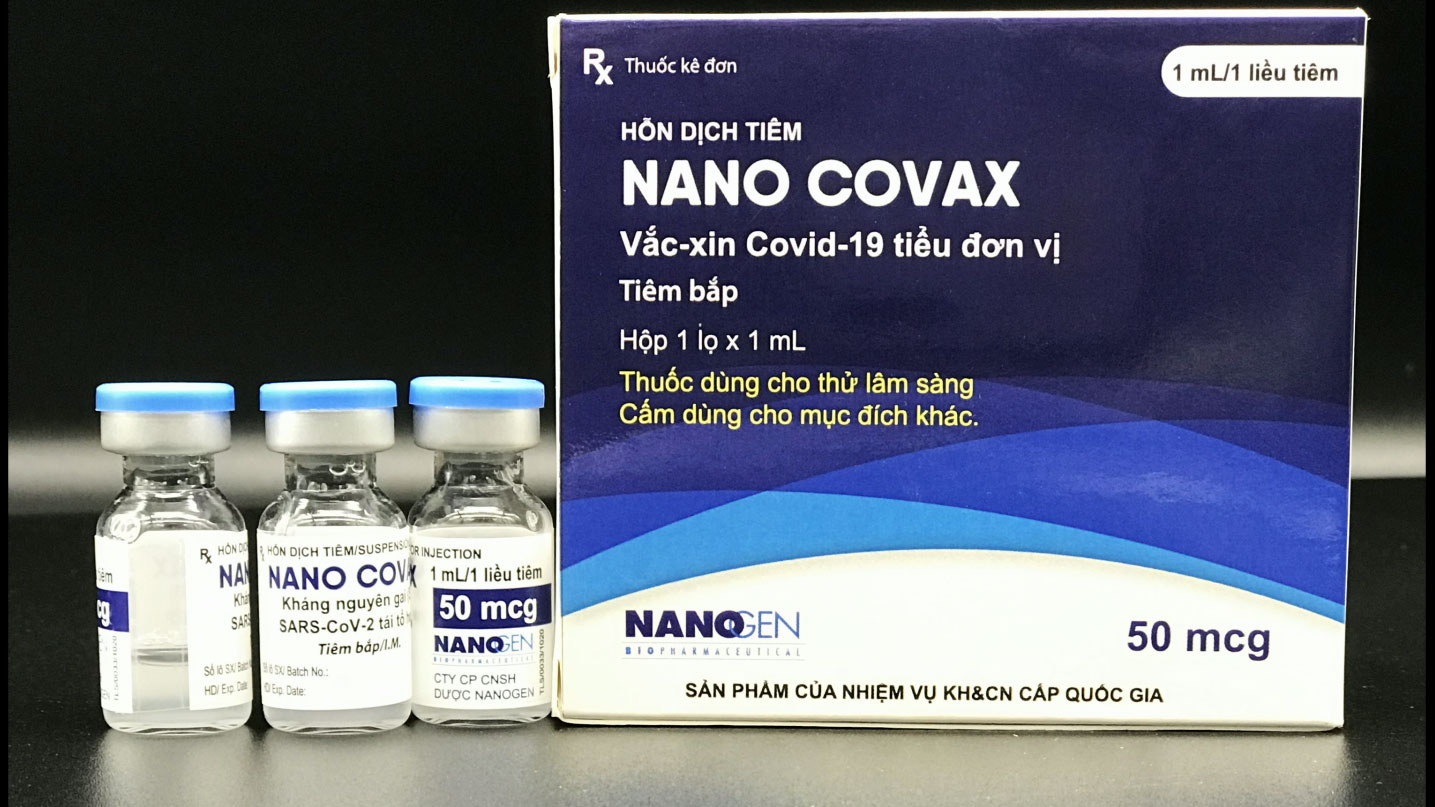
Đến giữa tháng 12/2020, sau nghiên cứu, sản xuất và thử hàng loạt trên động vật thành công, Bộ Y tế chính thức bấm nút cho phép thử nghiệm vắc-xin ngừa Covid-19 do Nanogen sản xuất trên người giai đoạn 1. Ngày 11/6, Bộ Y tế chính thức phê duyệt đề cương thử nghiệm giai đoạn 3 vắc-xin Nano Covax (liều 25 mcg). Giai đoạn 3 sẽ được thử nghiệm trên 13.000 tình nguyện viên. 2 nghiên cứu viên chính của giai đoạn này là Học Viện Quân y (Hà Nội) và Viện Pasteur TP.HCM ở Miền Nam. Hiện tại, 1.000 tình nguyện viên đã hoàn thành mũi tiêm thứ nhất.
Bộ Y tế thống nhất với Viện Pasteur TP.HCM và Học viện Quân y đẩy nhanh tốc độ thử nghiệm trên toàn bộ 13.000 tình nguyện viên, hoàn tất mũi 1 trước ngày 15/7 và xong mũi 2 trước ngày 15/8. Trong tháng 8, phải có dữ liệu báo cáo Bộ Y tế.
Sau hơn 2 tuần triển khai tiêm thử nghiệm giai đoạn 3, tính đến 17h00 ngày 24/6, đã tiêm thử nghiệm ứng viên vắc-xin Nano Covax mũi 1 cho 1007 tình nguyện viên. Khoảng 12.000 tình nguyện viên còn lại (Hưng Yên: 4.000, Long An: 2.000 người, Tiền Giang: 6.000 người) bắt đầu tiêm mũi 1 từ hôm nay, hoàn tất trước ngày 15/7 và tiêm xong mũi 2 trước ngày 15/8.
Ngày 15/6, Công ty Cổ phần Công nghệ sinh học dược Nanogen có văn bản gửi Thủ tướng về việc xin cấp phép khẩn cấp vắc-xin Covid-19 Nano Covax. Cụ thể, trong văn bản, Nanogen bày tỏ mong muốn vắc-xin Nano Covax sớm được cấp phép khẩn cấp có điều kiện, tương tự như các loại vắc-xin của Nga, Trung Quốc và Ấn Độ. Theo Nanogen, loại vắc-xin Covid-19 do đơn vị này nghiên cứu và sản xuất đã chứng minh được những thành công bước đầu, dựa trên các kết quả báo cáo giữa kỳ của thử nghiệm lâm sàng giai đoạn một và giai đoạn 2 đã được Hội đồng Đạo đức trong nghiên cứu y sinh (Bộ Y tế) chấp thuận và đánh giá tốt.
Bộ Y tế và Hội đồng đã thông qua đề cương nghiên cứu, triển khai thử nghiệm lâm sàng giai đoạn 3 cho Nano Covax hàm lượng 25 mcg/mL trên quy mô 13.000 người. Dựa trên các kết quả thử nghiệm lâm sàng, khả năng sinh miễn dịch của vắc-xin Nanocovax đạt 99,4%. So sánh với các loại vắc-xin khác trên thế giới là không hề thua kém. Tuy nhiên, ngay sau đó lãnh đạo Cục Khoa học công nghệ và Đào tạo, Bộ Y tế đã có phản hồi, cho rằng kiến nghị của Nanogen là nóng vội, số lượng 1.000 mẫu thử nghiệm giai đoạn 3 chưa nói lên được gì nhiều, các dữ liệu cần tiếp tục thu thập, nghiên cứu.
Bộ Y tế khẳng định việc đưa một vắc-xin tiêm rộng rãi cho người dân cần phải rất cẩn trọng, phải có đủ dữ liệu khoa học. Việc phê duyệt cấp phép thận trọng không phải để làm khó doanh nghiệp. Đại diện Bộ này cũng viện dẫn quy định của Tổ chức Y tế thế giới về việc vắc-xin được sử dụng khẩn cấp bắt buộc phải trải qua giai đoạn 3. Hiện các loại vắc-xin đã được thử nghiệm 3 giai đoạn và được WHO phê duyệt như AstraZenenca, Sputnik V, Pfizer, Sinopharm.
Nhật Hạ

